Jedna z głównych inicjatyw realizowanych przez grupę IDoc koncentruje się na opracowywaniu bezpieczniejszych i bardziej efektywnych narzędzi do chirurgii oka. To przedsięwzięcie stanowiło dla nas wyzwanie, ponieważ wykracza poza nasze tradycyjne obszary ekspertyzy. Niemniej jednak, to, że udało nam się zgromadzić zespół, który w ciągu niecałych trzech lat skutecznie zintegrował różnorodne kompetencje i zaawansował projekt do obecnej fazy trzeba uznać za naprawdę duże osiągnięcie.
Nasza podróż, polegająca na stopniowym gromadzeniu wiedzy i doświadczenia, pozwoliła w końcu na integrację wszystkich kluczowych komponentów. Cieszymy się niezmiernie, że możemy pochwalić się przeprowadzeniem pierwszych eksperymentów, w których wykorzystano manipulator robotyczny do usprawnienia procedur stosowanych w chirurgii oka. Działanie naszego układu wspomagane jest przez precyzyjne śledzenie pozycji narzędza chirurgicznego, aby w czasie rzeczywistym wyświetlać odpowiadające tej pozycji przekroje OCT.
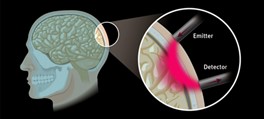
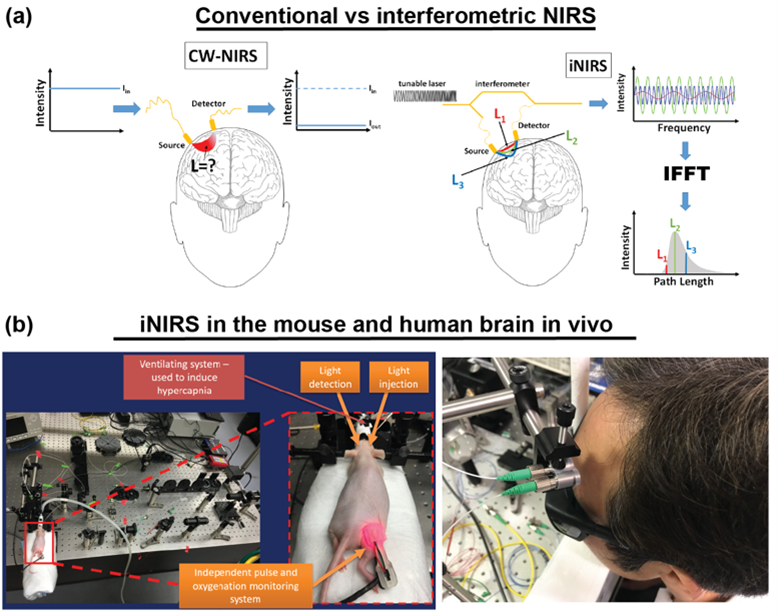
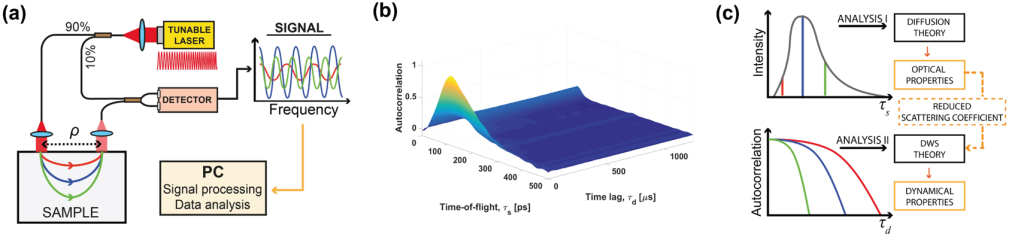
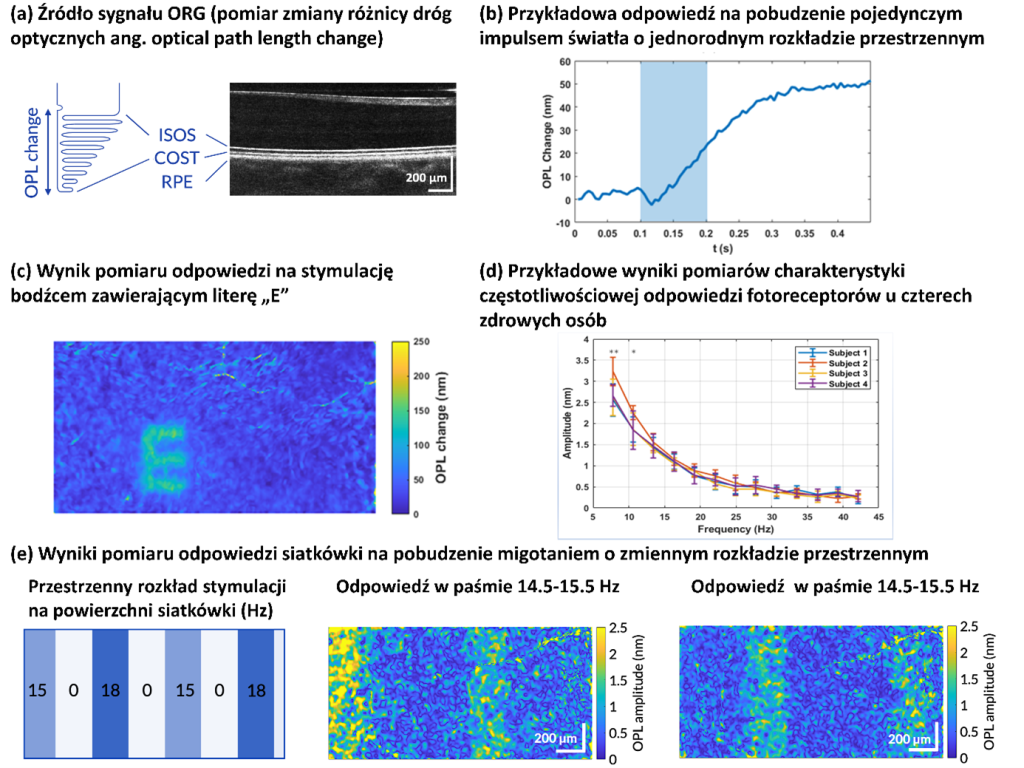
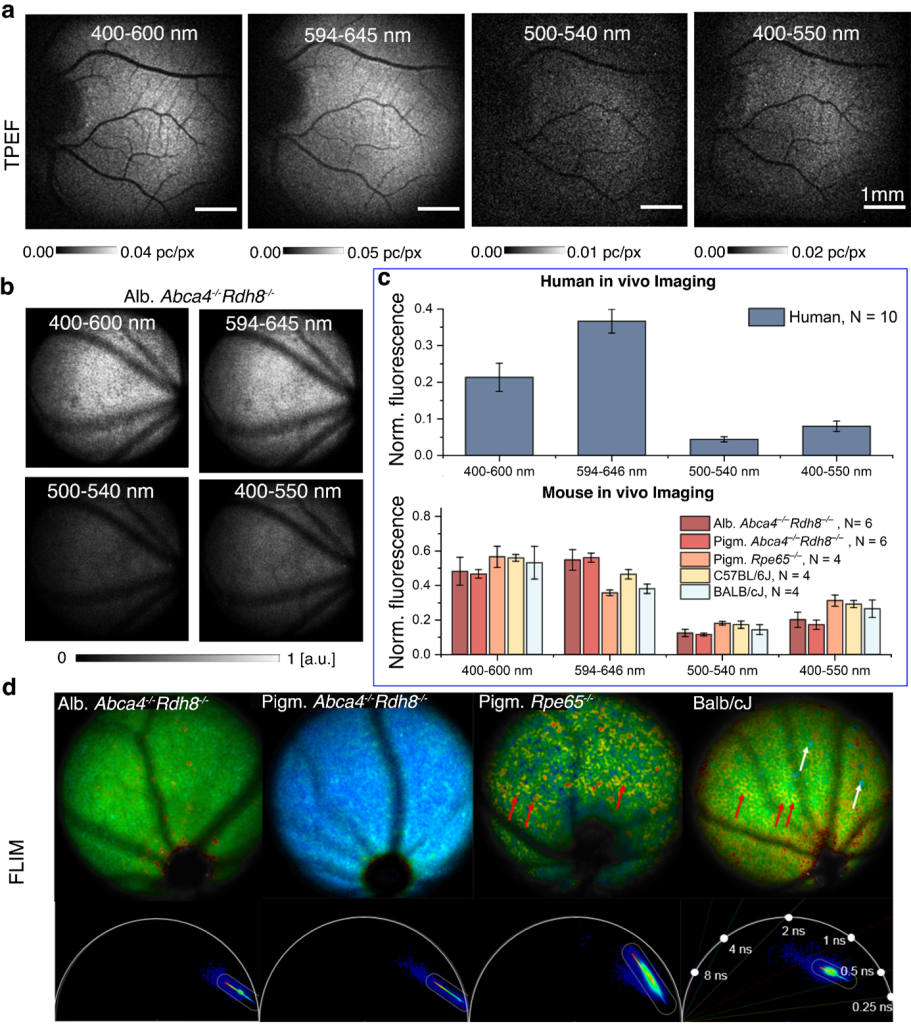
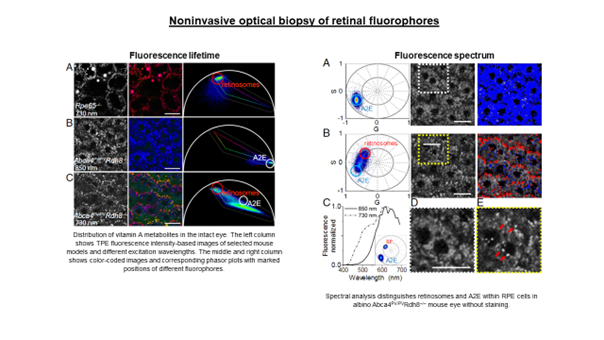
Kolejny projekt, w który zaangażowane było laboratorium IDoc od początku swojej działalności, dotyczy jednego z głównych celów ośrodka badawczego ICTER, czyli opracowania metod i narzędzi do obiektywnego wykrywania struktury i funkcji oka oraz ich zmian w przypadku chorób. Realizowaliśmy to we współpracy z grupą POB, wprowadzając nowatorską technikę zwaną optoretinografią. Łączymy ją z narzędziami biologii strukturalnej opracowanymi przez grupę ISB w celu analizy układu komórkowego i jego złożonych zmian podczas cyklu wzrokowego, aby zweryfikować nasze hipotezy dotyczące źródła sygnału funkcjonalnego, który mierzymy. We współpracy z grupą OBi weryfikujemy nasze wyniki z obrazowania funkcjonalnego metodami elektrofizjologii.
Dzięki współpracy to ambitne wyzwanie udało się zrealizować. W trakcie ostatnich eksperymentów obserwowaliśmy w sposób powtarzalny i po raz pierwszy, zmniejszone reakcje funkcjonalne u myszy poddanych czasowemu hamowaniu wzroku w porównaniu do ich reakcji na kilka godzin przed podaniem leku. Za pomocą optoretinografii udało nam się obiektywnie wykazać, że gdy centralne białko z rodziny PDE, które odgrywa rolę w fototransdukcji, zostaje zahamowane fotoreceptory w siatkówce myszy nie wydłużają się tak znacząco podczas ekspozycji na krótki błysk światła, jak w przypadku zdrowego oka.
Pomiar tak niewielkiej zmiany długości fotoreceptorów in vivo, a mówimy tu tylko o kilkudziesięciu nanometrach, może mieć ogromne znaczenie dla nauki o wzroku oraz okulistyki, dostarczając obiektywnego testu funkcjonalnego zdolności wzrokowej i zdrowia fotoreceptorów. To z kolei może przyspieszyć wybór terapii i badania jej skuteczności.
Czekamy na kolejne wyniki w tej dziedzinie.
Autorzy: