Siatkówka jest istotną częścią oka, ponieważ jest odpowiedzialna za przekształcanie światła w sygnały elektryczne, które są później przetwarzane w mózgu. Działa jak biologiczny fotodetektor. Obrazowanie struktury i funkcji żywej siatkówki ma kluczowe znaczenie dla skutecznego diagnozowania i leczenia chorób oczu oraz opracowywania leków. Informacje strukturalne o siatkówce można uzyskać m.in. dzięki badaniom OCT. Jednakże, zmiany funkcjonalne są pierwszymi oznakami wczesnych procesów patologicznych i często poprzedzają zmiany strukturalne; uzyskanie tych informacji jest obecnie bardzo trudne. Naukowcy z ICTER pracują nad nową metodą funkcjonalnego obrazowania dna oka, bazując na dwufotonowo wzbudzanej fluorescencji.
Siatkówka ma strukturę warstwową, która jest wypełniona różnymi fluoroforami. Na przykład, nabłonek barwnikowy siatkówki (RPE) zawiera lipofuscynę, produkt uboczny cyklu widzenia. Lipofuscyna gromadzi się z wiekiem, ale także wraz z postępem choroby. Inne przykłady to retinol i estry retinylowe (pochodne witaminy A aktywne w cyklu wzrokowym), melanina, FAD, NADH, kolagen i elastyna. Substancje te mogą dostarczyć cennych informacji o stanie zdrowia siatkówki i mogą być cennym narzędziem do wykrywania zmian funkcjonalnych w przebiegu zwyrodnienia plamki związanego z wiekiem, retinopatii cukrzycowej lub jaskry.
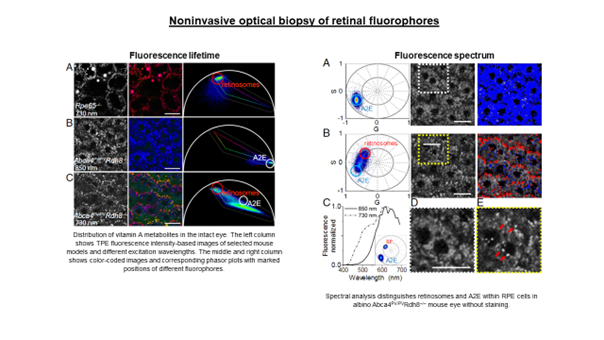
Standardowe obrazowanie autofluorescencji oka wizualizuje rozkład fluoroforów siatkówki, ale dostępna jest tylko informacja o intensywności. W rezultacie sygnały pochodzące od różnych fluoroforów nie mogą być rozróżnione. Lipofuscyna jest dominującym fluoroforem, a jej silny sygnał miesza się z innymi, pochodzącymi zwykle z znacznie słabszych źródeł. Różne fluorofory różnią się właściwościami fluorescencji, tj. czasem życia fluorescencji i widmem fluorescencji. Stanowi to dodatkowy parametr dyskryminacyjny, który pozwala je od siebie odróżnić.
Oko jest oknem na świat, ale ma też określony zakres transmisji. W związku z tym, wiele fluoroforów o widmach wzbudzenia w zakresie UV/niebieskim (<420 nm) nie może być wzbudzonych, a informacja w nich zawarta jest niedostępna. Naszym rozwiązaniem tego problemu jest zastosowanie wzbudzenia dwufotonowego. Schemat ten wykorzystuje krótkie (femtosekundowe) impulsy w bliskiej podczerwieni (dwukrotna długość fali), co pozwala ominąć ograniczenia wynikające z transmisji oka. Przykładowo, użycie impulsów femtosekundowych o długości fali 730 nm jest równoważne wzbudzeniu jednofotonowemu o długości fali 365 nm, co nie byłoby możliwe w żywym oku. Dodatkowe zalety tej metody to lepsza rozdzielczość, mniejsza fototoksyczność i mniejsze rozpraszanie.
W naszych badaniach dążymy do wizualizacji struktury i składu molekularnego tkanek oka, wykorzystując zarówno dyskryminację spektralną, jak i czasową. Przykładowo, obraz poniżej przedstawia rozkład czasu życia fluorescencji (FLIM) komórek nabłonka pigmentu siatkówki myszy Abca4PV/PV (model choroby Stargardta u ludzi). Obraz odzwierciedla różnice w subkomórkowej dystrybucji endogennych fluoroforów w nabłonku barwnikowym. Krótsze czasy życia (kolor niebiesko-zielony) są związane z A2E, składnikiem lipofuscyny. Czerwone granulki (dłuższy czas życia) mogą być związane z estrami retinylowymi.
Autor: dr Jakub Bogusławski jboguslawski@ichf.edu.pl
Zespół: Grażyna Palczewska, Jakub Bogusławski, Łukasz Kornaszewski, Maciej Wojtkowski
Publikacja:
Grazyna Palczewska, Jakub Boguslawski, Patrycjusz Stremplewski, Lukasz Kornaszewski, Jianye Zhang, Zhiqian Dong, Xiao-Xuan Liang, Enrico Gratton, Alfred Vogel, Maciej Wojtkowski, Krzysztof Palczewski, “Noninvasive two-photon optical biopsy of retinal fluorophores,” Proceedings of the National Academy of Sciences 117(36), 22532-22543 (2020).

