Optyka dyfuzyjna oferuje nieinwazyjne podejście do badania tkanek biologicznych, w tym ludzkiego mózgu in vivo [1]. Spektroskopia w bliskiej podczerwieni (NIRS) [2] i spektroskopia korelacyjna (DCS) są podstawowymi metodami optyki dyfuzyjnej [3, 4]. W obu podejściach światło oświetla tkankę, a rozproszone dyfuzyjnie fotony są zbierane w pewnej odległości od emitera (zwykle 2-3 cm). NIRS wykorzystuje wykryty sygnał do oszacowania właściwości optycznych (współczynnika absorpcji i zredukowanego współczynnika rozpraszania), podczas gdy DCS określa ilościowo przepływ krwi na podstawie czasowych zmian natężenia rejestrowanego światła. Chociaż metody te zostały zastosowane do monitorowania natlenienia mózgu i przepływu krwi, ich najczęściej stosowane wersje opierają się na laserach o ciągłej długości fali (CW), co wyklucza bezwzględne pomiary optycznych i dynamicznych właściwości tkanek [5].
NIRS w dziedzinie czasu (TD-NIRS) umożliwia kwantyfikację właściwości optycznych poprzez analizę rozkładu czasu przelotu fotonów w próbce (tak zwany rozkład czasu lotu, ang. time-of-flight, TOF) [9-12]. Zdolność tę można również połączyć ze spektroskopią korelacyjną w celu uzyskania informacji o przepływie krwi z rozdzielczością TOF (lub długością ścieżki fotonów). W ten sposób możemy lepiej odróżnić fotony przechodzące przez warstwy powierzchowne (krótkie TOF) od fotonów podróżujących w głąb mózgu (długie TOF). Ponadto, biorąc pod uwagę rozkład TOF, możemy oszacować właściwości optyczne w celu uzyskania bezwzględnego wskaźnika przepływu krwi (BFI), skutecznie łącząc możliwości TD-NIRS z DCS w jedną modalność. Takie podejście nazywa się spektroskopią korelacyjną w dziedzinie czasu (TD-DCS) [6, 7].
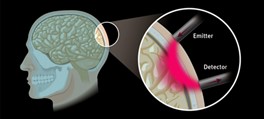
Obraz: Zastosowanie interferometrii do monitorowania funkcji mózgu.
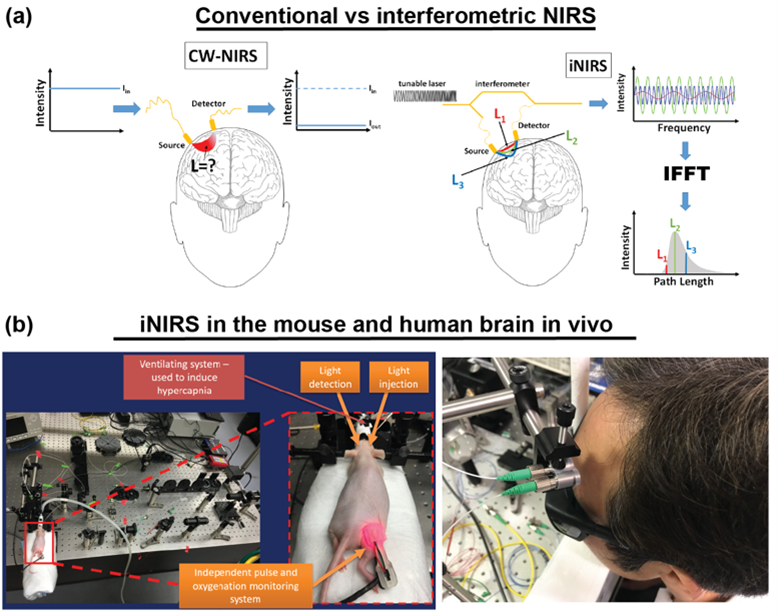
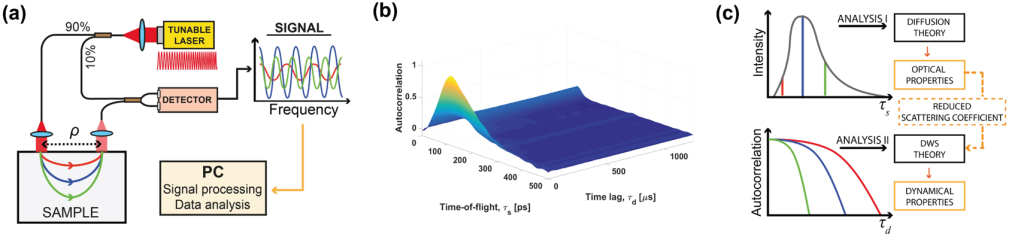
Chociaż TD-DCS jest skuteczną techniką stosowaną nawet w klinikach, opiera się ona tylko na natężeniu światła. Dlatego TD-DCS nie umożliwia wykrywania fazy optycznej [8]. Faza optyczna jest dostępna w interferometrycznej spektroskopii w bliskiej podczerwieni (ang. interferometric near-infrared spectroscopy, iNIRS) [9]. Technika iNIRS wykorzystuje interferometrię opartą na czasowo spójnym przestrajalnym laserze w celu osiągnięcia rozdzielczości TOF. W szczególności iNIRS uzupełnia konwencjonalną konfigurację NIRS o przestrajalne źródło światła i ramię referencyjne. Pole emitowane z próbki jest rekombinowane z polem referencyjnym. Częstotliwość dudnień sygnału koduje długości ścieżek fotonów (lub czasy przelotu). Krótkie ścieżki generują niższe częstotliwości dudnień niż długie ścieżki. W związku z tym rozkład czasu przelotu fotonów można uzyskać poprzez odwrotną transformację Fouriera zarejestrowanego sygnału (analogicznie jak w przypadku techniki OCT z laserem strojonym, ang. swept-source OCT). Jednak iNIRS dostarcza znacznie więcej informacji (w porównaniu z NIRS) dzięki dwuwymiarowej funkcji autokorelacji (ACF) reemitowanego pola optycznego. W iNIRS ACF jest mierzona jako funkcja opóźnienia czasowego z rozdzielczością TOF. Ten dwuwymiarowy pomiar (rysunek poniżej) koduje informacje o absorpcji, rozpraszaniu i indeksie przepływu krwi (BFI) w próbce.
iNIRS został zweryfikowany w fantomach tkanki biologicznej [9], mózgu myszy [10] i ludzkim mózgu in vivo [11]. Jednak oryginalny iNIRS (jak też DCS i TD-DCS) wykorzystuje światłowody jednomodowe do detekcji rozproszonego światła, wymagając czasów integracji 0,5-1 sekundy. Ten przedział czasowy jest zbyt długi, aby wykrywać szybkie zmiany przepływu krwi w ludzkim mózgu, które mogą być powiązane z sygnałami neuronowymi.
Aby przezwyciężyć te ograniczenia, niedawno zaproponowaliśmy równoległą interferometryczną spektroskopię w bliskiej podczerwieni (πNIRS). W πNIRS używamy światłowodów wielomodowych do zbierania rozproszonego światła i szybkiej, dwuwymiarowej kamery do rejestracji światła. Każdy piksel kamery działa efektywnie jako pojedynczy kanał iNIRS. Przetworzone sygnały z każdego piksela są więc uśredniane przestrzennie, aby skrócić całkowity czas integracji. Co więcej, detekcja interferometryczna zapewnia nam unikalną możliwość dostępu do zespolonej informacji (amplitudy i fazy) o świetle emitowanym z próbki, co przy ponad 8000 równoległych kanałów umożliwiło nam wykrycie mózgowego przepływu krwi przy czasie integracji wynoszącym zaledwie 10 ms (∼100x szybciej niż konwencjonalny iNIRS). Wykorzystaliśmy takie podejście do monitorowania pulsacyjnego przepływu krwi w ludzkim przedramieniu in vivo. Wykazaliśmy również, że podejście to może monitorować aktywację kory przedczołowej poprzez rejestrowanie zmian przepływu krwi w czole badanego podczas czytania nieznanego tekstu [12].
Tekst: dr habil. Dawid Borycki
Team:
dr habil. Dawid Borycki
mgr inż. Klaudia Nowacka
Referencje:
- S. Samaei, P. Sawosz, M. Kacprzak, Z. Pastuszak, D. Borycki, and A. Liebert, „Time-domain diffuse correlation spectroscopy (TD-DCS) for noninvasive, depth-dependent blood flow quantification in human tissue in vivo,” Sci Rep 11, 1817 (2021).
- D. Borycki, O. Kholiqov, and V. J. Srinivasan, „Interferometric near-infrared spectroscopy directly quantifies optical field dynamics in turbid media,” Optica 3, 1471-1476 (2016).
- D. Borycki, O. Kholiqov, S. P. Chong, and V. J. Srinivasan, „Interferometric Near-Infrared Spectroscopy (iNIRS) for determination of optical and dynamical properties of turbid media,” Opt Express 24, 329-354 (2016).
- D. Borycki, O. Kholiqov, and V. J. Srinivasan, „Reflectance-mode interferometric near-infrared spectroscopy quantifies brain absorption, scattering, and blood flow index in vivo,” Opt Lett 42, 591-594 (2017).
- S. Samaei, K. Nowacka, A. Gerega, Z. Pastuszak, and D. Borycki, „Continuous-wave parallel interferometric near-infrared spectroscopy (CW piNIRS) with a fast two-dimensional camera,” Biomed Opt Express 13, 5753-5774 (2022).


