Zdolność do nieinwazyjnego dostępu do procesów metabolicznych podczas cyklu wzrokowego ma kluczowe znaczenie dla opracowania terapii przeciwko chorobom zwyrodnieniowym siatkówki. Opracowaliśmy protokół uzyskiwania in vivo obrazów fluorescencji wzbudzonego dwufotonowo dna oka ludzkiego.
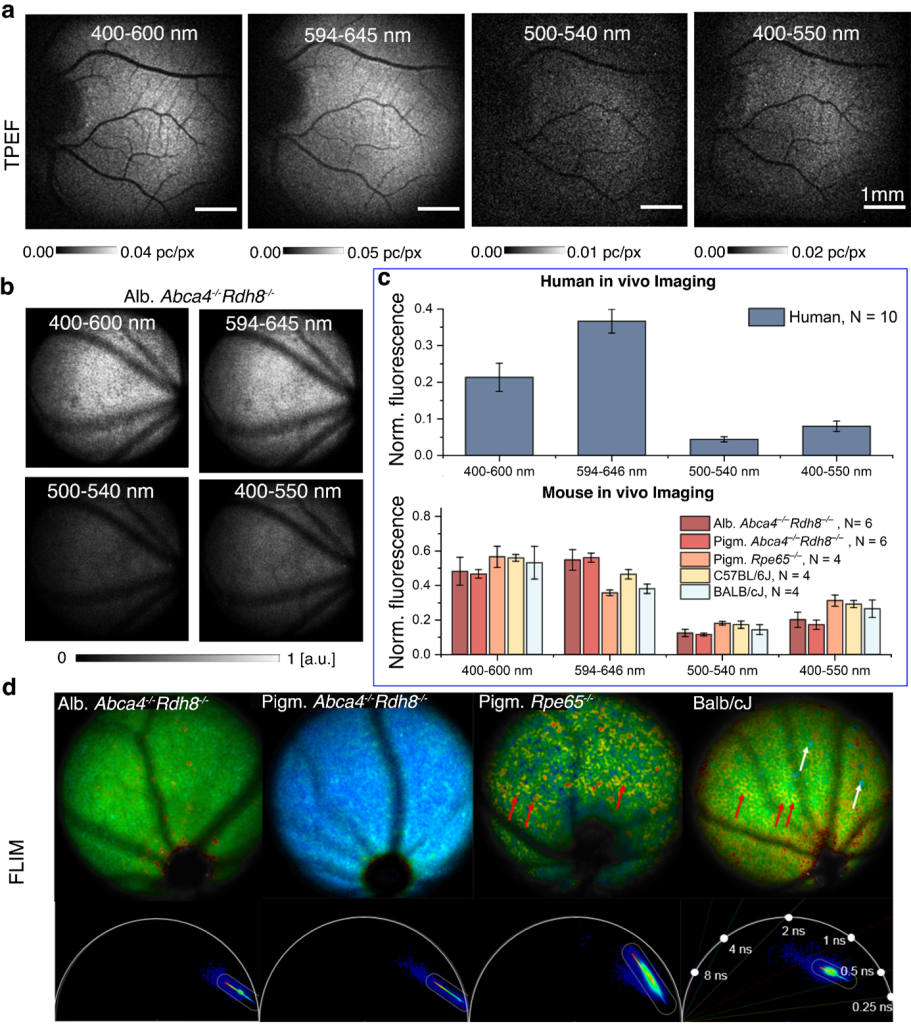
Cykl widzenia to seria przemian chemicznych, podczas których powstają różne półprodukty fluorescencyjne. Autofluorescencja dna oka indukowana niebieskim światłem umożliwia obrazowanie fluoroforów siatkówki. Jednak ze względu na fundamentalne ograniczenia metoda ta ogranicza się do obrazowania lipofuscyn, które zawierają produkty uboczne cyklu wzrokowego, ale nie odzwierciedlają bezpośrednio zmian w funkcji fotoreceptorów. Widma absorpcyjne fluoroforów biorących udział w cyklu wdzenia, takich jak estry retinylu, mieszczą się w zakresie widmowym UV. Jednak absorpcja i rozpraszanie w przedniej części oka, a także względy bezpieczeństwa wykluczają promieniowanie UV z zastosowań w obrazowaniu okulistycznym.
Wzbudzenie dwufotonowe pozwala ominąć to ograniczenie i wzbudzić niedostępne wcześniej fluorofory, tworząc nowe możliwości diagnostyczne. Fluorofory siatkówki mogą być wzbudzane przy minimalnej absorpcji i znacznie niższym rozpraszaniu i fototoksyczności przy użyciu impulsów femtosekundowych o długości fal bliskiej podczerwieni. Wcześniej pokazaliśmy, że obrazowanie za pomocą skanującego oftalmoskopu laserowego z dwufotonowo-wzbudzaną absorpcją okazało się bardzo przydatne u myszy. Niedawno, w 2022 roku, po raz pierwszy zedemonstrowaliśmy obrazowanie oka ludzkiego in vivo przy użyciu dwufotonowo-wzbudzanej fluorescencji w bliskiej podczerwieni. Zbudowaliśmy kompaktowy instrument oparty na skaningowym oftalmoskopie laserowym (SLO) z niestandardowym femtosekundowym laserem światłowodowym i wydajną detekcją fotonów oraz zaprojektowaliśmy zaawansowane przetwarzanie danych, które umożliwiło pomiar sygnałów dwufotonowych na poziomie pojedynczych fotonów. W rezultacie możemy zwizualizować rozkład fluoroforów siatkówki przy ekspozycji znacznie poniżej granicy bezpieczeństwa dla ludzkiego oka.
Zmierzyliśmy dziesiątki ochotników, aby potwierdzić solidność techniki i rozszerzyliśmy konfigurację eksperymentalną o pracę z modelami mysimi w celu zbadania różnych chorób oczu, takich jak zwyrodnienie plamki żółtej związane z wiekiem czy choroba Stargardta. Obrazowanie przeprowadzono w ciemnym pokoju bez wcześniejszej adaptacji do ciemności lub rozszerzenia źrenic. W większości przypadków udało nam się zarejestrować sygnał fluorescencyjny i zrekonstruować obraz siatkówki. Technika ta rozwiewa obawy dotyczące bezpieczeństwa, umożliwiając uzyskiwanie dobrej jakości obrazów przy niskiej ekspozycji oka na światło lasera. Potwierdziliśmy przydatność systemu do przyszłego zastosowania klinicznego tej metody obrazowania. Nasze wyniki stanowią istotny krok w kierunku funkcjonalnego obrazowania ludzkiego oka, które bezpośrednio odzwierciedla lokalne zmiany w funkcji siatkówki.
Tekst: dr Michał Dąbrowski
Zespół:
Publikacje:
- G. Palczewska, J. Boguslawski, P. Stremplewski, Ł. Kornaszewski, J. Zhang, Z. Dong, X.-X. Liang, E. Gratton, A. Vogel, M. Wojtkowski, and K. Palczewski, Noninvasive two-photon optical biopsy of retinal fluorophores, Proc. Natl. Acad. Sci. U. S. A 117, 22532 (2020)
- D. Stachowiak, J. Bogusławski, A. Głuszek, Z. Łaszczych, M. Wojtkowski, and G. Soboń, „Frequency-doubled femtosecond Er-doped fiber laser for two-photon excited fluorescence imaging, Biomed. Opt. Express 11, 4431 (2020)
- J. Boguslawski, G. Palczewska, S. Tomczewski, J. Milkiewicz, P.Kasprzycki, D. Stachowiak, K. Komar, M. J. Marzejon, B. L. Sikorski, A. Hudzikowski, A. Głuszek, Z. Łaszczych, K. Karnowski, G. Soboń, K. Palczewski, and M. Wojtkowski, In vivo imaginh of the human eye using a 2-photon-excited fluorescence scanning laser ophthalmoscope, JCI 132, 154218 (2022)
- J. Bogusławski, S. Tomczewski, M. Dąbrowski, K. Komar, J. Milkiewicz, G. Palczewska, K. Palczewski, and M. Wojtkowski, In vivo imaging of the muna retina using a two-photon excited fluorescence ophthalmoscope, STAR Protocols 4, 102225 (2023)
- G. Palczewska, M. Wojtkowski, and K. Palczewski, From mouse to human: Accessing the biochemistry of vision in vivo by two-photon excitation, Prog. Retin. Eye Res. 93, 101170 (2023)

